Leis das Reações Químicas
(Leis Ponderais)
DEFINIÇÃO
No final do século XVIII, os cientistas Antoine Laurent Lavoisier e Joseph Louis Proust, através de estudos experimentais, concluíram que as reações químicas obedecem a determinadas leis. Essas leis são chamadas de leis ponderais e relacionam as massas das substâncias, reagentes e produtos participantes de uma reação química.
LEI DE LAVOISIER
A Lei da Conservação das Massas foi elaborada por Lavoisier após determinar a massa total de um sistema fechado, concluindo que a soma das massas dos reagentes é igual a soma das massas dos produtos.
Exemplo: 2 gramas de gás hidrogênio reagem com 16 gramas de gás oxigênio produzindo 18 gramas de água.
mreagentes = mprodutos
Hidrogênio + Oxigênio = Água
2g + 16g = 18g
2g + 16g = 18g
A lei, portanto, segue os enunciados:
“Em um sistema fechado, a massa total dos reagentes é igual à massa total dos produtos”.
“Na natureza, nada se perde, nada se cria, tudo se transforma.”
LEI DE PROUST
A Lei das Proporções Constantes foi enunciada após o químico Joseph Louis Proust observar que em uma reação química as massas dos reagentes e as massas dos produtos estabelecem sempre uma proporção constante.
| C | + | O2 | CO2 | |
| 3 g | : | 8 g | : | 11 g |
| 6 g | 16 g | 22 g | ||
| 9 g | 24 g | 33 g |
Quando a massa de um dos reagentes dobra, as massas dos demais, reagentes e produtos, dobram também. Ao triplicarmos a massa de alguma substância participante da reação, acontecerá o mesmo, a massa de todas as demais substâncias triplicará e assim sucessivamente.
Podemos observar que:
| mgásoxigênio/mcarbono | mgás carbônico/mcarbono | mgás carbônico/mgás oxigênio |
| 8/3 = 2,66 | 11/3 = 3,66 | 11/8 = 1,375 |
| 16/6 = 2,66 | 22/6 = 3,66 | 22/16 = 1,375 |
| 24/9 = 2,66 | 33/9 = 3,66 | 33/24 = 1,375 |
As relações entre massa O2 /massa C, massa CO2 /massa C, massa CO2 /massa O2 , são sempre constantes.
As leis ponderais de Lavoisier e Proust foram muito importantes para estudos posteriores como, por exemplo, com base nessas leis o cientista John Dalton elaborou sua teoria sobre a estrutura atômica, que ficou conhecida como a teoria atômica de Dalton.
Os conceitos das leis ponderais auxiliam a prever as quantidades desconhecidas de reagentes ou produtos em uma reação química, através de um cálculo, conhecido como cálculo estequiométrico.
EXEMPLOS
I) Considerando que 200g de mercúrio reagem completamente com 16g de oxigênio para formar óxido de mercúrio, qual seria a massa de oxigênio necessária para produzir135 g de óxido de mercúrio?
Aplicando a lei de Lavoisier, sabemos que na reação completa de 200 g de mercúrio com 16 g de oxigênio resulta em 216 g de óxido de mercúrio, pois:
Mercúrio + Oxigênio → Óxido de Mercúrio
200 g + 16 g = 216 g
Para produzir 135 g de óxido de mercúrio, precisamos relacionar as proporções. Pela lei de Proust temos:
Mercúrio + Oxigênio → Óxido de Mercúrio
200 g + 16 g → 216 g
x 135 g
Logo:
16/x = 216/135→ x= 10 g
10 g é a massa necessária de oxigênio para obter 135 g de óxido de mercúrio.
16/x = 216/135
10 g é a massa necessária de oxigênio para obter 135 g de óxido de mercúrio.
II) Supondo que 80 g de mercúrio são colocados em contato com 6 g de oxigênio,qual seria o reagente em excesso e qual seria sua massa?
Pela lei de Proust:
Mercúrio + Oxigênio → Óxido de Mercúrio
200 g + 16 g = 216 g
80 g x
Logo:
200/80 = 16/x→ x = 6,4
Mercúrio + Oxigênio → Óxido de Mercúrio
200 g + 16 g = 216 g
80 g x
Logo:
200/80 = 16/x
80 g de mercúrio reagiriam completamente com 6,4 g de oxigênio. Porém, existem apenas 6 g de oxigênio, havendo excesso de mercúrio.
Pela Lei de Proust:
Mercúrio + Oxigênio → Óxido de Mercúrio
200 g + 16 g = 216 g
y 6 g
y 6 g
200/y = 16/6 → y = 75 g
A massa de mercúrio que reagiu foi 75 g, como a massa de mercúrio presente era de 80 g, existem 5 g em excesso.
COMPOSIÇÃO CENTESIMAL
Com base nas Leis Ponderais, também podemos definir a percentagem, em massa, de cada elemento presente em uma substância, ou seja: a composição centesimal indica a massa (em gramas) de cada elemento presente em 100 g de substância.
Exemplo: se 450 g de água foram originados pela reação de 50 g de hidrogênio com 400 g de oxigênio, qual será a sua composição centesimal?
Hidrogênio + Oxigênio → Água
50 g 400 g 450 g
100 g
50 g 400 g 450 g
100 g
Calculando a quantidade de hidrogênio:
50 g de hidrogênio/450 g de água = x g de hidrogênio/100 g de água
x = (50 * 100)/450
x = 11,1 g
50 g de hidrogênio/450 g de água = x g de hidrogênio/100 g de água
x = (50 * 100)/450
x = 11,1 g
Repetindo o procedimento para o oxigênio:
400 g de oxigênio/450 g de água = y g de oxigênio/100 g de água
y = (400 * 100)/450
y = 88,9 g
400 g de oxigênio/450 g de água = y g de oxigênio/100 g de água
y = (400 * 100)/450
y = 88,9 g
A conclusão é que, em cada 100 gramas de água, é formada por 11,1 gramas de hidrogênio e 88,9 gramas deoxigênio. A composição percentual da água é de 11,1% de hidrogênio e 88,9% de oxigênio.
EXERCÍCIO
(Mackenzie-SP) A tabela a seguir, com dados relativos à equação citada, refere-se a duas experiências realizadas. Então, podemos afirmar que:
| C+ O | |||
| 1° Experiência | 12 g | 32g | X g |
| 2° Experiência | 36 g | Y g | 132 g |
a) X é menor que a soma dos valores das massas dos reagentes da 1ª experiência.
b) X = Y
c) Y é igual ao dobro do valor da massa de carbono que reage na 2ª experiência.
d) 32/Y = X/132
e) Y = 168
c) Y é igual ao dobro do valor da massa de carbono que reage na 2ª experiência.
d) 32/Y = X/132
e) Y = 168
Resolução
Pela Lei de Lavoisier podemos calcular X:
C + O2 CO212 g + 32 g = 44 g
X = 44 g
X = 44 g
Pela lei de Proust podemos calcular Y:
a CO2
12 g + 32 g = 44 g
36 g Y
36 g Y
12 g/36 g = 32g/Y
Y = (36*32)/12
Y = 96
Y = (36*32)/12
Y = 96
A resposta correta é a alternativa D, pois 32/96 = 44/132.
Lei de Dalton (Lei das proporções múltiplas)
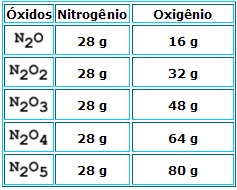
Se uma massa fixa de um elemento se combina com massas diferentes de um segundo elemento, para formar compostos diferentes, estas massas (diferentes) estão entre si numa relação de números inteiros pequenos. O nitrogênio se combina com o oxigênio, formando diferentes óxidos:
Na primeira reação ocorre a formação do monóxido de carbono, cuja proporção de carbono por oxigênio é uma razão de números inteiros de resultado igual a 1. Na segunda reação, temos a formação do dióxido de carbono (CO2), cuja relação carbono por oxigênio é uma razão de números inteiros 1/2. Lei de Gay Lussac (Só vale para reações entre gases) Numa reação onde só participam gases e nas mesmas condições de temperatura e pressão, existe uma proporção de números inteiros e pequenos entre volumes dos gases participantes da reação. Comprovação da Lei: Através da comprovação da Lei você poderá notar que o volume do gás produto (2 C(g)) não é necessariamente igual ao dos reagentes. Retome o exemplo da comprovação da Lei: Reagentes: 1V + 3V = 4V Produtos: 2V Exemplo: Em determinadas condições de presão e temperatura, verificou-se que 0,70 L de monóxido de nitrogênio reage com 0,35 L de oxigênio para formar 0,70 L de dióxido de nitrogênio. Mostrar que esses dados estão de acordo com a Lei Volumétrica de Gay-Lussac. A proporção montada a partir dos volumes fornecidos é: O,70 : 0,35 : 0,70 Dividindo-a pelo menor termo da proporção, temos: 0,70/0,35 : 0,35/0,35 : 0,70/0,35 Ou seja: 2 : 1 : 2 (uma proporção de números inteiros e pequenos). É bom lembrar que numa reação química “o volume dos gases pode não se conservar, a massa sempre se conserva (Lei de Lavoisier)”.
Se uma massa fixa de um elemento se combina com massas diferentes de um segundo elemento, para formar compostos diferentes, estas massas (diferentes) estão entre si numa relação de números inteiros pequenos. O nitrogênio se combina com o oxigênio, formando diferentes óxidos:

Verifica-se que, permanecendo constante a massa do nitrogênio, as massas do oxigênio, entre si, numa relação simples de números inteiros e pequenos, ou seja, 1:2: 3:4: 5.
Exemplo:
Para duas razões conhecidas, temos:
Para duas razões conhecidas, temos:
1C + 1O → 1CO razão 1/1 = 1
1C + 1O2 → CO2 razão 1/2
1C + 1O2 → CO2 razão 1/2
Na primeira reação ocorre a formação do monóxido de carbono, cuja proporção de carbono por oxigênio é uma razão de números inteiros de resultado igual a 1. Na segunda reação, temos a formação do dióxido de carbono (CO2), cuja relação carbono por oxigênio é uma razão de números inteiros 1/2. Lei de Gay Lussac (Só vale para reações entre gases) Numa reação onde só participam gases e nas mesmas condições de temperatura e pressão, existe uma proporção de números inteiros e pequenos entre volumes dos gases participantes da reação. Comprovação da Lei: Através da comprovação da Lei você poderá notar que o volume do gás produto (2 C(g)) não é necessariamente igual ao dos reagentes. Retome o exemplo da comprovação da Lei: Reagentes: 1V + 3V = 4V Produtos: 2V Exemplo: Em determinadas condições de presão e temperatura, verificou-se que 0,70 L de monóxido de nitrogênio reage com 0,35 L de oxigênio para formar 0,70 L de dióxido de nitrogênio. Mostrar que esses dados estão de acordo com a Lei Volumétrica de Gay-Lussac. A proporção montada a partir dos volumes fornecidos é: O,70 : 0,35 : 0,70 Dividindo-a pelo menor termo da proporção, temos: 0,70/0,35 : 0,35/0,35 : 0,70/0,35 Ou seja: 2 : 1 : 2 (uma proporção de números inteiros e pequenos). É bom lembrar que numa reação química “o volume dos gases pode não se conservar, a massa sempre se conserva (Lei de Lavoisier)”.

Nenhum comentário:
Postar um comentário